日本药企第一三共制药(Daiichi Sankyo)近日宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已针对口服消灭抗癌药Vanflyta(quizartinib)治疗复发性/难治性FLT3 -ITD急性髓性白血病(AML)成人患者的营销授权申请(MAA)发布了不推荐批准的意见。在美国监管方面,FDA在今年4月将Vanflyta的新药申请(NDA)审查时间延长了3个月,至2019年8月25日。根据当时发布的声明,FDA需要时间来审查第一三共提交的与FDA要求相关的额外数据。但在今年6月, FDA 发布了一封完整回应函(CRL),拒绝批准Vanflyta。
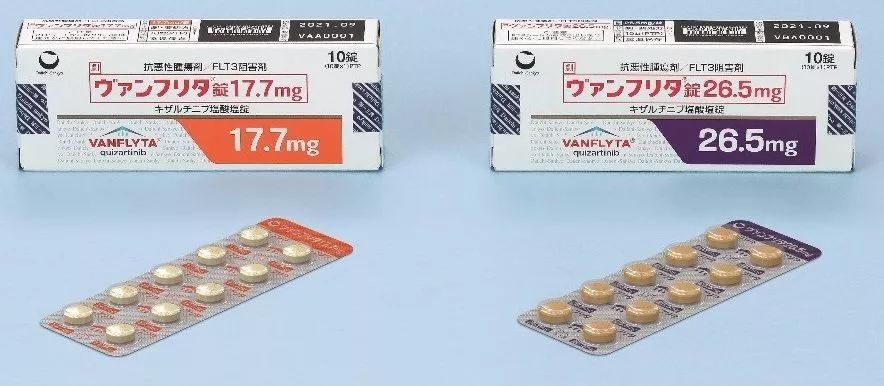
Vanflyta于今年6月获得日本卫生劳动福利部(日本厚生劳动省)批准,这也是该药在全球范围内的首个监管批准。本月初,Vanflyta已在日本上市销售。此次日本批准,基于全球性关键III期临床研究QuANTUM-R以及一项在日本复发性/难治性FLT3-ITD AML患者中开展的II期临床研究的数据。
在值得一提的是,QuANTUM-R研究是评估一种FLT3抑制剂作为口服单药疗法相对化疗治疗复发性/难治性FLT3-ITD AML患者显着延长总生存期的首个随机III期研究。在该研究中,与挽救性化疗并发症,Vanflyta口服单药疗法使死亡风险显着降低24%(HR = 0.76,p = 0.0177,95%CI:0.58-0.98),总生存期显着延长(中位OS) :6.2个月[短期检验95%CI:5.3-7.2]与4.7个月[十年检验95%CI:4.0-5.5]);Vanflyta治疗组估计的1年存活率27%,挽救性化疗组为20%。安全性方面,接受Vanflyta治疗的患者最常见的药物不良反应是恶心(33.2%,80/241例),心电图QT延长(24.9%,60/241例),贫血(24.9%,60 / 241例)和血小板减少(21.2%,51/241例)。来自日本II期研究的数据显示,在中期分析时,已经达到了预先指定的符合完全缓解率的主要终点。该研究中Vanflyta的疗效和安全性与QuANTUM-R研究中一致。第一三共肿瘤研发执行副总裁兼全球负责人Antoine Yver医学博士表示:“虽然我们对CHMP的意见感到失望,但我们将评估从CHMP收到的反馈,导致Vanflyta治疗欧洲复发/难治性FLT3-ITD AML病人的下一步措施。尽管面临这一挫折,我们仍然相信Vanflyta对联合化疗治疗新诊断的FLT3-ITD AML 患者。我们仍然致力于将Vanflyta作为一种潜在的治疗选择,用于美国,欧洲和世界其他地区这种侵略性的,难以治疗的AML亚型。”
Vanflyta的活性药物quizartinib属于第二代FLT3抑制剂,该药是一种口服小分子受体酪氨酸激酶抑制剂,选择性取代抑制FLT3。在美国,quizartinib已获FDA 认可的治疗复发性/难治性FLT3-ITD AML成人患者的突破性药物资格,治疗复发性/难治性AML的快速通道替代。从而,quizartinib在美国,欧盟均被授予治疗AML的孤儿药资格,在日本被授予了治疗FLT3突变AML的孤儿药资格。AML是一种侵袭性性血液和肿瘤癌,导致患者体内功能失常的癌变白细胞不受控制地增生和积累,并影响正常血细胞的生成。FLT3 基因突变是AML最常见的基因异常改变之一,其中FLT3 -ITD是最常见的FLT3突变,影响约1/4的AML患者。FLT3-ITD是白血病高负担,预后差并对AML患者疾病管理有显着影响的一种驱动突变。与未携带FLT3-ITD突变的AML患者相比,FLT3-ITD AML患者总体预后更差,包括复发率增加,复发后死亡风险增加,造血干细胞移植后复发的可能性更高。
东京和慕尼黑–(2019年10月18日)– 第一三共株式会社(以下称第一三共)今天宣布,欧洲药品管理局(EMA)的人用药用产品委员会(CHMP)对药品的使用持负面意见quizartinib的上市授权申请书(MAA),用于治疗患有复发/难治性FLT3-ITD急性髓细胞性白血病(AML)的成人。 CHMP意见基于MAA提交的全球关键QuANTUM-R研究奎扎替尼的数据。QuANTUM-R的结果发表在《柳叶刀》杂志上。 “虽然我们对这种观点感到失望,但我们将评估从CHMP收到的反馈,以确定在欧洲治疗quizartinib复发/难治性FLT3-ITD AML患者的下一步措施,”医学硕士,Antoine Yver博士说,第一三共执行副总裁兼肿瘤学研究与开发全球负责人。“尽管遭受了挫折,我们仍然相信quizartinib对于FLT3-ITD AML患者的潜在益处,我们期待着全球关键的3期QuANTUM研究的结果,该研究首次评估了quizartinib联合化疗对新发患者的疗效-诊断为FLT3-ITD AML。我们仍然致力于在美国,欧洲和世界其他地区,将奎扎替尼作为这种激进且难以治疗的AML亚型的潜在治疗选择进行推广。” 关于Quizartinib
Quizartinib是一种口服FLT3抑制剂,是Daiichi Sankyo的AML系列产品中的主要产品。
经批准的测试检测到,Quizartinib目前已获准以VANFLYTA?的商标名在日本用于治疗患有复发/难治性FLT3-ITD AML的成年患者。它于2019年10月10日在日本推出。 Quantum-First的一项研究最近刚刚完成,这是一项全球性的关键性3期研究,评估了quizartinib联合标准化疗联合用于新诊断的FLT3-ITD AML。 其他正在进行的研究包括北美和欧洲针对儿童和年轻成人复发/难治性FLT3-ITD AML的1/2期开发;与美拉德美坦(一种研究性MDM2抑制剂)联合用于治疗复发/难治性FLT3-ITD AML和新诊断的FLT3-ITD AML不适合在美国进行强化化疗的1期开发药物Milademetan是一种尚未被批准用于任何适应症的研究性药物在任何国家。安全性和有效性尚未确定。 关于FLT3-ITD AML
AML是一种侵略性血液和骨髓癌,会导致无法正常运行并干扰正常血细胞生成的恶性白细胞不受控制地生长和积累。在欧盟,每年大约有18,000例新的AML病例,其五年生存率不到30%。 FLT3基因突变是AML中最常见的遗传异常之一。FLT3-ITD是最常见的FLT3突变,大约影响四分之一的AML患者.FLT3-ITD是一种驱动程序突变,具有高白血病负担,不良预后并对AML患者的疾病治疗产生重大影响。与没有这种突变的患者相比,患有FLT3-ITD AML的患者的总体预后较差,包括复发率增加,复发后死亡的风险增加以及造血干细胞移植后复发的可能性更高。