近日,全球最具影响力的临床医学期刊《新英格兰医学杂志》发表了由北京大学-清华大学生命科学联合中心邓宏魁研究组、解放军总医院陈虎研究组及首都医科大学吴昊研究组合作的研究论文《CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia》,我国科学家们完成了世界首例基因编辑造血干细胞移植治疗艾滋病白血病患者的研究。WHO列出的世界五大绝症中,艾滋病和白血病就占了两项。当“绝症”遇上“绝症”,是否可能“绝处逢生”?!

截取自NEJM
题外故事
1995年,住在柏林的美国男子Timothy Ray Brown被确诊为艾滋病。2006年,他又一次被病魔击中,这一次是急性髓系白血病。2007年,白血病复发后他采取了Hu?tter医生的建议,进行了一次特殊的异基因造血干细胞移植——骨髓来自一位对艾滋病“天然免疫”的相合供者。12年后的今天,他仍然是全球唯一被治愈的艾滋病患者。我们知道HIV病毒会作用于CCR5受体并侵入人体细胞,而这位对艾滋病“天然免疫”的供者体内存在一种罕见的名为CCR5-delta32的基因突变,这种突变能够使该基因失效,并让携带者抵抗主要HIV毒株。然而,全世界的人群中CCR5天然突变者如凤毛麟角,我们是否可以人为修饰并干扰CCR5的表达呢?预知后事如何,请听下文分解!

图:蒂莫西·雷·布朗(Timothy Ray Brown)
病例报道
2016年5月,一位27岁的小伙子不幸被诊断为艾滋病(AIDS)合并T细胞急性淋巴细胞白血病(T-ALL)。患者在使用抗逆转录病毒药物治疗1年后HIV感染得到控制,随后接受了6个疗程的ALL标准化疗方案并获得了形态学完全缓解(CR)伴MRD阴性(<0.01%)。中国骨髓库中有一位33岁男性正常供者的骨髓和他HLA全相合,伴有未突变的CCR5基因。2017年7月9日,患者清髓预处理后进行了异基因造血干细胞移植。
供者的外周血单个核细胞(PBMC)经磁珠分选出造血干祖细胞(CD34+ HSPCs),并应用CRISPR技术编辑CCR5位点。移植期间应用环孢素、甲氨蝶呤、巴利昔单抗(CD25抗体)、吗替麦考酚酯、糖皮质激素和他克莫司以预防和治疗移植物抗宿主病(GVHD)。
研究方法
研究旨在评估CRISPR-Cas9技术编辑HSPCs移植治疗罹患血液病伴HIV-1阳性患者的安全性和有效性。HLA全相合供者的PBMC经磁珠分选出CD34+HSPC后用无血清培养基培养48h后转染含Cas9蛋白和2条靶向CCR5 gRNA的核糖核蛋白复合体。转染后细胞培养2h。分选所余CD34阴性细胞和编辑后的CD34+细胞共同移植患者体内。移植前后对编辑细胞进行全基因组测序以分析潜在脱靶效应。
研究结果
中性粒细胞和血小板植入分别发生在移植后的d13和d27,淋巴细胞数量和T细胞亚群亦在移植后上升,CD4+细胞数量在移植后第6个月逐渐恢复和稳定。完全供者嵌合状态在移植后第4周获得,并持续到移植后19个月。ALL的形态学完全缓解发生在移植后第4周并持续19个月。流式未检测到白血病相关表型的MRD。ABL标准化的WT1小于0.5%。全基因组测序检测到CD34+ HSPCs的CCR5插入或缺失效率为17.8%。以防基因编辑后的HSPCs无法长期植入, 分选出的CD34阴性细胞(占CD34+细胞的28.8%)亦同时移植。移植后的19个月内,CCR5在骨髓基因组的敲除比例波动在5.2%至8.28%(图B),且CRSPR介导的CCR5敲除可以在多种造血细胞中见到。(图C)
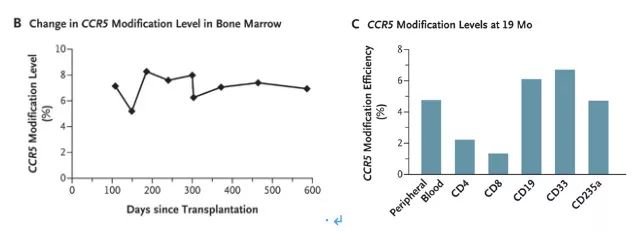
截取自NEJM
患者移植后未出现急性免疫反应。发热性中性粒细胞减少(3级)和菌血症(表皮葡萄球菌,3级)在移植后首2周发生,标准抗生素治疗可缓解。急性GVHD(皮肤,1级)、尿频尿急(1级)、巨细胞病毒血症(3级)和单纯疱疹再激活发生在移植后第2个月。未观察到CCR5基因编辑相关不良反应。
为评估基因编辑后的脱靶效应,研究者对编辑的HSPC基因组进行了高通量测序。测序未检测到DNA裂解等脱靶效应。在移植后第15周、第12月、第19月,研究者再次进行测序,仍未检测到脱靶效应。
此前研究工作已证实,输注自体CCR5编辑的T细胞可以在抗逆转录病毒治疗期间减少患者的病毒负荷,提示CCR5敲除或能缩短抗逆转录病毒的治疗时间。本项研究中,在移植后7个月,当患者CD4+细胞已恢复正常且血清检测不到病毒RNA时,经患者知情同意短暂中止了抗逆转录病毒治疗。中止后第4个月,患者血清病毒负荷增长到了 3×107,因此恢复用药。随后数月患者病毒负荷降回正常水平。
讨论
在先前各种基于HSPC的治疗探索中,外源DNA随机插入基因组减低了治疗的有效性,同时可能发生急性免疫反应或导致肿瘤形成。在本项研究中,Cas9核糖核蛋白应用非病毒转染法因而避免了外源DNA的插入及Cas9在靶细胞的长期存留(脱靶原因之一)。研究对移植前后的样本进行全基因组测序未发现单个核苷酸变异体、大缺失或染色体重排,患者亦未出现明显不良反应,以上均证实了该研究的安全性。但是,CCR5编辑的较低效率同样也限制了脱靶分析的深度。近来,有研究显示CCR5-Δ32的突变可能导致减寿发生,但本项研究中CCR5在造血系统内的编辑不会改变其在非造血组织的表达。CCR5 CRISPR编辑的 CD34+细胞移植对循环骨髓细胞的基因组产生的基因干扰低于8%,且未见基因编辑相关脱靶效应。
参考文献Xu L, Wang J, Liu Y,et al.CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia.N Engl J Med. 2019 Sep 26;381(13):1240-1247. doi: 10.1056/NEJMoa1817426. Epub 2019 Sep 11.
https://www.nejm.org/doi/full/10.1056/NEJMoa1817426
责任编辑:Amiee
版权声明版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。 想了解更多血液肿瘤最新进展吗?想知晓血液肿瘤大咖的诊治经验吗?想与全国各地血液肿瘤医生交流与讨论吗?扫描下方二维码,添加血液肿瘤小编微信,带你走进血液肿瘤学术殿堂!
